Геометрические изомеры различаются. Стереоизомерия. Тема: Введение в органическую химию

 I. Изомерия (от греч. isos - равный) Берцелиус, 1830 г. Изомеры - это вещества, которые имеют одинаковую молекулярную формулу (одинаковый качественный и количественный состав), но отличаются последовательностью связывания атомов и (или) расположением их в пространстве и обладают разными свойствами.
I. Изомерия (от греч. isos - равный) Берцелиус, 1830 г. Изомеры - это вещества, которые имеют одинаковую молекулярную формулу (одинаковый качественный и количественный состав), но отличаются последовательностью связывания атомов и (или) расположением их в пространстве и обладают разными свойствами.
 БЕРЦЕЛИУС (Berzelius), Йёнс Якоб 1779 г. – 1848 г. Знаменитый шведский химик. С 1807 профессор медицины и фармации в Стокгольме.
БЕРЦЕЛИУС (Berzelius), Йёнс Якоб 1779 г. – 1848 г. Знаменитый шведский химик. С 1807 профессор медицины и фармации в Стокгольме.
 С 2 Н 6 О диметиловый эфир Ткип= -24 С этиловый спирт Ткип= 78 С н-бутан Ткип= -0, 5 С С 4 Н 10 изобутан Ткип= -11, 7 С
С 2 Н 6 О диметиловый эфир Ткип= -24 С этиловый спирт Ткип= 78 С н-бутан Ткип= -0, 5 С С 4 Н 10 изобутан Ткип= -11, 7 С
 Число изомеров в ряду алканов Название Формула Число Формула изомеров Название Число изомеров CH 4 метан 1 C 11 H 24 ундекан 159 C 2 H 6 этан 1 C 12 H 26 додекан 355 C 3 H 8 пропан 1 C 13 H 28 тридекан 802 C 4 H 10 бутан 2 C 14 H 30 тетрадекан 1 858 C 5 H 12 пентан 3 C 15 H 32 пентадекан 4 347 C 6 H 14 гексан 5 C 20 H 42 эйкозан C 7 H 16 гептан 9 C 25 H 52 пентакозан 36 797 588 C 8 H 18 октан 18 C 30 H 62 триаконтан 4 111 846 763 C 9 H 20 нонан 35 C 40 H 82 тетраконтан 62 491 178 805 831 C 10 H 22 декан 75 366 319
Число изомеров в ряду алканов Название Формула Число Формула изомеров Название Число изомеров CH 4 метан 1 C 11 H 24 ундекан 159 C 2 H 6 этан 1 C 12 H 26 додекан 355 C 3 H 8 пропан 1 C 13 H 28 тридекан 802 C 4 H 10 бутан 2 C 14 H 30 тетрадекан 1 858 C 5 H 12 пентан 3 C 15 H 32 пентадекан 4 347 C 6 H 14 гексан 5 C 20 H 42 эйкозан C 7 H 16 гептан 9 C 25 H 52 пентакозан 36 797 588 C 8 H 18 октан 18 C 30 H 62 триаконтан 4 111 846 763 C 9 H 20 нонан 35 C 40 H 82 тетраконтан 62 491 178 805 831 C 10 H 22 декан 75 366 319
 II. Гомология Группы органических соединений однотипной структуры с одинаковой функциональными группами, отличающиеся друг от друга по количеству групп -CH 2 - в углеродной цепи, составляют гомологический ряд. Гомологический ряд метана
II. Гомология Группы органических соединений однотипной структуры с одинаковой функциональными группами, отличающиеся друг от друга по количеству групп -CH 2 - в углеродной цепи, составляют гомологический ряд. Гомологический ряд метана
 III. Изологические ряды. l l Это ряды веществ, построенных из того же числа атомов углерода, но отличающиеся количественным составом атомов Н, т. е. каждый следующий член ряда содержит на 2 атома Н меньше, чем предыдущий: С 2 Н 6 этан С 2 Н 4 этилен С 2 Н 2 ацетилен
III. Изологические ряды. l l Это ряды веществ, построенных из того же числа атомов углерода, но отличающиеся количественным составом атомов Н, т. е. каждый следующий член ряда содержит на 2 атома Н меньше, чем предыдущий: С 2 Н 6 этан С 2 Н 4 этилен С 2 Н 2 ацетилен






 Структурная изомерия 3. Таутомерия (прототропная или динамическая изомерия) Таутомери я (от греч. ταύτίς - тот же самый и μέρος - мера) - явление сосуществования двух изомерных форм, находящихся в подвижном равновесии и способных самопроизвольно переходить друг в друга.
Структурная изомерия 3. Таутомерия (прототропная или динамическая изомерия) Таутомери я (от греч. ταύτίς - тот же самый и μέρος - мера) - явление сосуществования двух изомерных форм, находящихся в подвижном равновесии и способных самопроизвольно переходить друг в друга.







Src="https://present5.com/presentation/73124296_273676330/image-22.jpg" alt="Конформация >С ------- С Конформация >С ------- С
 Геометрическая изомерия Геометрические изомеры – имеют одинаковый порядок (последовательность) связей в молекуле, но отличаются расположением атомов (групп) в пространстве относительно плоскости двойной связи или малого цикла.
Геометрическая изомерия Геометрические изомеры – имеют одинаковый порядок (последовательность) связей в молекуле, но отличаются расположением атомов (групп) в пространстве относительно плоскости двойной связи или малого цикла.
Src="https://present5.com/presentation/73124296_273676330/image-24.jpg" alt="Цис- и транс-изомеры бутена-2 У каждого атома >C=C Цис- и транс-изомеры бутена-2 У каждого атома >C=C
 «по сю и по ту сторону» реки Лейты Цислейтания – наименование земель австрийской короны; показано красным; 1867 -1918 г. Транслейтания - наименование земель венгерской короны; показано зелёным
«по сю и по ту сторону» реки Лейты Цислейтания – наименование земель австрийской короны; показано красным; 1867 -1918 г. Транслейтания - наименование земель венгерской короны; показано зелёным




 E, Z-номенклатура 2 1 Е-1 -нитро-1 -бром-2 -хлорпентен 1 2 Z-1 -нитро-1 -бром-2 -хлорпентен 1. Используя правила Кана-Ингольда-Прелога, определяют относительное старшинство заместителей, связанных двойной связью и дают им номера по старшинству 1 или 2.
E, Z-номенклатура 2 1 Е-1 -нитро-1 -бром-2 -хлорпентен 1 2 Z-1 -нитро-1 -бром-2 -хлорпентен 1. Используя правила Кана-Ингольда-Прелога, определяют относительное старшинство заместителей, связанных двойной связью и дают им номера по старшинству 1 или 2.
 а) Атом с большим атомным номером является старшим относительно атома с меньшим номером. б) Если два атома являются изотопами, то преимущество имеет атом с большим массовым числом. 2. Если две наиболее старшие группы расположены по одну сторону от плоскости π-связи, то конфигурация заместителей обозначается символом Z. (от немецкого zusammen вместе) Если же эти группы находятся по разные стороны от плоскости π-связи, то конфигурацию обозначают символом Е (от немецкого entgegen напротив)
а) Атом с большим атомным номером является старшим относительно атома с меньшим номером. б) Если два атома являются изотопами, то преимущество имеет атом с большим массовым числом. 2. Если две наиболее старшие группы расположены по одну сторону от плоскости π-связи, то конфигурация заместителей обозначается символом Z. (от немецкого zusammen вместе) Если же эти группы находятся по разные стороны от плоскости π-связи, то конфигурацию обозначают символом Е (от немецкого entgegen напротив)



 Луи Пастер (Louis Pasteur) (27. 12. 1822 -28. 09. 1895) Французский химик, величайший исследователь XIX столетия "Асимметрия - это то, что отличает органический мир от неорганического" (этот закон положил начало стереохимии). Асимметричные кристаллы обладают свойством вращать поляризованный свет.
Луи Пастер (Louis Pasteur) (27. 12. 1822 -28. 09. 1895) Французский химик, величайший исследователь XIX столетия "Асимметрия - это то, что отличает органический мир от неорганического" (этот закон положил начало стереохимии). Асимметричные кристаллы обладают свойством вращать поляризованный свет.
 Энантиомеры – пространственные изомеры, молекулы которых относятся между собой как предмет и несовместимое с ним зеркальное изображение. (от греч. enantios – противоположный).
Энантиомеры – пространственные изомеры, молекулы которых относятся между собой как предмет и несовместимое с ним зеркальное изображение. (от греч. enantios – противоположный).
 Хиральность (англ. chirality, от греч. chéir - рука), понятие в химии, характеризующее свойство объекта быть несовместимым со своим отображением в идеальном плоском зеркале.
Хиральность (англ. chirality, от греч. chéir - рука), понятие в химии, характеризующее свойство объекта быть несовместимым со своим отображением в идеальном плоском зеркале.






 Фишер (Fischer) Эмиль Герман (9. 10. 1852, Эйскирхен, – 15. 7. 1919, Берлин), немецкий химик-органик и биохимик.
Фишер (Fischer) Эмиль Герман (9. 10. 1852, Эйскирхен, – 15. 7. 1919, Берлин), немецкий химик-органик и биохимик.
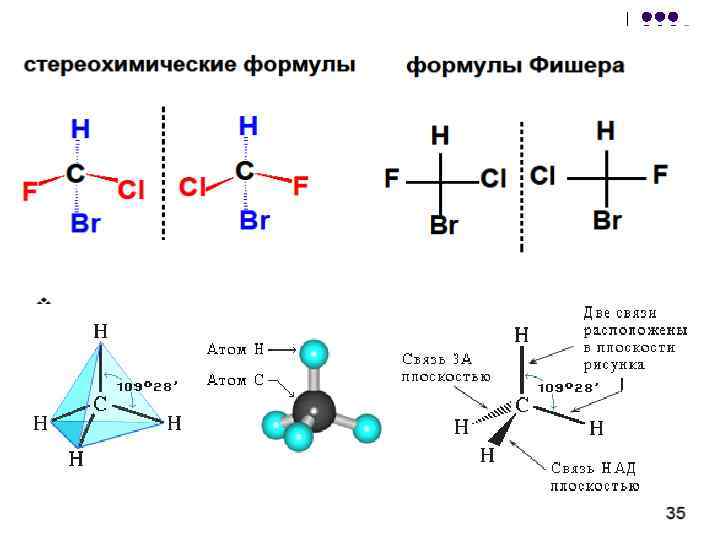


 Проекции Фишера можно преобразовать: l l 1. чётное число перестановок заместителей не меняет формулу; 2. нечётное число перестановок заместителей приводит к формуле антипода (энантиомера); 3. запрещается поворот формулы на 90 или 270 , а также выведение формулы из этой плоскости (эти действия приводят к формуле антипода); 4. допускается поворот всей формулы в плоскости чертежа на 180 ;
Проекции Фишера можно преобразовать: l l 1. чётное число перестановок заместителей не меняет формулу; 2. нечётное число перестановок заместителей приводит к формуле антипода (энантиомера); 3. запрещается поворот формулы на 90 или 270 , а также выведение формулы из этой плоскости (эти действия приводят к формуле антипода); 4. допускается поворот всей формулы в плоскости чертежа на 180 ;
 Относительная конфигурация 1906 г. , по предложению М. А. Розанова L- и D-изомеры (от латинских слов laevus – левый и dexter – правый).
Относительная конфигурация 1906 г. , по предложению М. А. Розанова L- и D-изомеры (от латинских слов laevus – левый и dexter – правый).



 Система Кана–Ингольда–Прелога? Роберт Сидни Кан Ингольд Кристофер Прелог Владимир (9. 06. 1899 -15. 09. 1981) (28. 10. 1893– 8. 10. 1970) (23. 07. 1906– 07. 01. 1998) (Великобритания) (Швейцария)
Система Кана–Ингольда–Прелога? Роберт Сидни Кан Ингольд Кристофер Прелог Владимир (9. 06. 1899 -15. 09. 1981) (28. 10. 1893– 8. 10. 1970) (23. 07. 1906– 07. 01. 1998) (Великобритания) (Швейцария)



 Общее число оптических изомеров определяется формулой N = 2 n , n число центров хиральности. I III IV 2 -амино-3 -гидроксибутановая кислота
Общее число оптических изомеров определяется формулой N = 2 n , n число центров хиральности. I III IV 2 -амино-3 -гидроксибутановая кислота
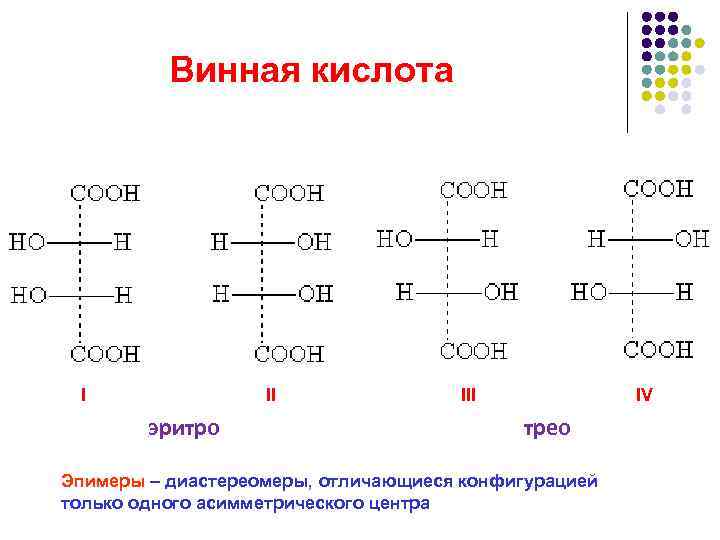 Винная кислота I III IV эритро трео Эпимеры – диастереомеры, отличающиеся конфигурацией только одного асимметрического центра
Винная кислота I III IV эритро трео Эпимеры – диастереомеры, отличающиеся конфигурацией только одного асимметрического центра

 Рацемат (от латинского racemus – виноград). При смешивании эквимолярных количеств D - и L - стереизомеров образуются оптически неактивные смеси, получившие название рацемических S (от лат. sinister – левый) и R (лат. rectus – правый); рацемат обозначают символом RS. Расщепление рацемических смесей: 1. Механический метод (метод Пастера). 2. Микробиологический метод 3. Ферментативный метод. 4. Химический метод. Афинная хроматография
Рацемат (от латинского racemus – виноград). При смешивании эквимолярных количеств D - и L - стереизомеров образуются оптически неактивные смеси, получившие название рацемических S (от лат. sinister – левый) и R (лат. rectus – правый); рацемат обозначают символом RS. Расщепление рацемических смесей: 1. Механический метод (метод Пастера). 2. Микробиологический метод 3. Ферментативный метод. 4. Химический метод. Афинная хроматография
 ВЗАИМОСВЯЗЬ СТЕРЕОХИМИЧЕСКОГО СТРОЕНИЯ С ПРОЯВЛЕНИЕМ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ. Адреналин, эпинефрин ИЮПАК: 1 -(3, 4 -дигидроксифенил)-2 метиламиноэтанол - гормон мозгового слоя надпочечников животных и человека. Медиатор нервной системы холоднокровных. Из двух энантиомеров адреналина наибольшую фармакологическую активность проявляет R(-) адреналин.
ВЗАИМОСВЯЗЬ СТЕРЕОХИМИЧЕСКОГО СТРОЕНИЯ С ПРОЯВЛЕНИЕМ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ. Адреналин, эпинефрин ИЮПАК: 1 -(3, 4 -дигидроксифенил)-2 метиламиноэтанол - гормон мозгового слоя надпочечников животных и человека. Медиатор нервной системы холоднокровных. Из двух энантиомеров адреналина наибольшую фармакологическую активность проявляет R(-) адреналин.

 ВЗАИМОСВЯЗЬ СТЕРЕОХИМИЧЕСКОГО СТРОЕНИЯ С ПРОЯВЛЕНИЕМ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ. правовращающий изопропиладреналин (изадрин) проявляет в 800 раз более сильное бронхорасширяющее действие, чем его левовращающий энантиомер.
ВЗАИМОСВЯЗЬ СТЕРЕОХИМИЧЕСКОГО СТРОЕНИЯ С ПРОЯВЛЕНИЕМ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ. правовращающий изопропиладреналин (изадрин) проявляет в 800 раз более сильное бронхорасширяющее действие, чем его левовращающий энантиомер.

 Диастереомеры – пространственные изомеры, молекулы которых НЕ относятся между собой как предмет и несовместимое с ним зеркальное отображение.
Диастереомеры – пространственные изомеры, молекулы которых НЕ относятся между собой как предмет и несовместимое с ним зеркальное отображение.

 Конформационная изомерия Конформационная изомерия возникает как результат различного расположения частей одной и той же молекулы друг относительно друга, достигаемого при вращении этих частей вокруг простой С-С связи, соединяющей два атома.
Конформационная изомерия Конформационная изомерия возникает как результат различного расположения частей одной и той же молекулы друг относительно друга, достигаемого при вращении этих частей вокруг простой С-С связи, соединяющей два атома.
 (от лат. conformatio - форма, расположение), различные пространственные формы, принимаемые молекулами в результате свободного вращения отдельных фрагментов вокруг простых С-С связей.
(от лат. conformatio - форма, расположение), различные пространственные формы, принимаемые молекулами в результате свободного вращения отдельных фрагментов вокруг простых С-С связей.







 69% 31% Ван-дер-Ваальсово напряжение – обусловлено силами отталкивания между валентно не связанными большими по объёму заместителями.
69% 31% Ван-дер-Ваальсово напряжение – обусловлено силами отталкивания между валентно не связанными большими по объёму заместителями.
Пространственные изомеры (стереоизомеры) имеют одинаковый качественный и количественный состав и одинаковый порядок связывания атомов (химическое строение), но разное пространственное расположение атомов в молекуле.
Выделяют два вида пространственной изомерии: оптическая и геометрическая.
Оптическая изомерия
В оптической изомерии различные фрагменты молекул располагаются по-разному относительно некоторого атома, т.е. имеют различную конфигурацию. Например:
Такие молекулы не являются идентичными, они относятся друг к другу как предмет и его зеркальное отображение и называются энантиомерами.
Энантиомеры обладают свойствами хиральности . Простейший случай хиральности обусловлен наличием в молекуле центра хиральности (хирального центра), которым может служить атом, содержащий четыре различных заместителя. У такого атома отсутствуют элементы симметрии. В связи с этим его также называют асимметрическим.
Чтобы установить, является ли молекула хиральной, необходимо построить ее модель, модель ее зеркального изображения (рис. 3.1, а) и выяснить, совмещаются ли они в пространстве. Если не совмещаются - молекула хиральна (рис. 3.1, б), если совмещаются - ахиральна.

Рис. 3.1.

Все химические свойства энантиомеров идентичны. Одинаковы и их физические свойства за исключением оптической активности: одна форма вращает плоскость поляризации света влево , другая - на тот же по величине угол вправо .
Смесь равных количеств оптических антиподов ведет себя как индивидуальное химическое соединение, лишенное оптической активности и сильно отличающееся по физическим свойствам от каждого из антиподов. Такое вещество называется рацемической смесью , или рацематом.
При всех химических превращениях, при которых образуются новые асимметричные атомы углерода, всегда получаются рацематы. Существуют специальные приемы разделения рацематов на оптически активные антиподы.
В случае наличия в молекуле нескольких асимметрических атомов возможна ситуация, когда пространственные изомеры не будут оптическими антиподами. Например:

Пространственные изомеры, не являющиеся энантиомерами по отношению друг к другу, называются диастереомерами.
Частный случай диастереомеров - геометрические (цис- траис-) изомеры.
Геометрическая изомерия
Геометрическая (цис-транс-) изомерия свойственна соединениям, содержащим двойные связи (С=С, C=N и др.), а также неароматическим циклическим соединениям и обусловлена невозможностью свободного вращения атомов вокруг двойной связи или в цикле. Заместители в геометрических изомерах могут быть расположены по одну сторону плоскости двойной связи или цикла - ^wc-положение, либо по разные стороны - тирш/с-положение (рис. 3.2).

Рис. 3.2. Дис-изомер (а) и транс -изомер (б)
Геометрические изомеры обычно существенно различаются по физическим свойствам (температурам кипения и плавления, растворимости, дипольным моментам, термодинамической устойчивости и др.)
- Термин «хиральность» означает, что два предмета находятся в такомотношении друг к другу, как левая и правая руки (от греч. chair - рука),т.е. представляют собой зеркальные изображения, не совпадающие при попытке совместить их в пространстве.
Изомерия лигандов
Изомерия лигандов подразделяется на связевую (которая определяется разным типом координации одного и того же лиганда), и собственно изомерию лиганда.
Примерами связевой изомерии может служить существование нитро- и нитрито-комплексов кобальта(III) состава K 3 и K 3 , в которых координация лиганда NO 2 - осуществляется, соответственно, через атом азота или атом кислорода. Другой пример – координация тиоцианат-иона NCS - через атом азота или через атом серы, с образованием тиоцианато-N- или тиоцианато-S-комплексов.
Кроме того, лиганды сложного строения (например, аминокислоты) могут сами по себе образовывать изомеры, координация которых ведет к образованию комплексов одинакового состава с разными свойствами.
Геометрическая изомерия вызвана неодинаковым размещением лигандов во внутренней сфере относительно друг друга. Необходимым условием геометрической изомерии является наличие во внутренней координационной сфере не менее двух различных лигандов. Геометрическая изомерия проявляется преимущественно у комплексных соединений, имеющих октаэдрическое строение, строение плоского квадрата или квадратной пирамиды.
Комплексные соединения с тетраэдрическим, треугольным и линейным строением геометрических изомеров не имеют, поскольку места расположения лигандов двух разных видов вокруг центрального атома равноценны.
Комплексы, имеющие строение плоского квадрата, при наличии двух разных лигандов L ′ и L ′′ уже могут иметь два изомера (цис- и транс-):
Примером комплексного соединения, имеющего цис- и транс-изомеры, может служить дихлородиамминплатина(II):
Отметим, что комплексное соединение состава со структурой плоского квадрата не может иметь изомеров: положение лиганда L ′′ равновероятно в любом углу квадрата. Когда же появляется два разных лиганда, то уже возможно существование двух изомеров (цис- и транс-), отличающихся по свойствам. Так, цис-дихлородиамминплатина (II) – оранжево-желтые кристаллы, хорошо растворимые в воде, а транс-дихлородиамминплатина(II) – кристаллы бледно-желтого цвета, растворимость которых в воде несколько ниже, чем у цис-изомера.
С увеличением числа различных лигандов во внутренней сфере растет число геометрических изомеров. Для хлорида нитро(гидроксиламин)аммин(пиридин)платины(II) Cl получены все три изомера:
Октаэдрические комплексы могут иметь множество изомеров. Если в комплексном соединении такого рода все шесть лигандов одинаковы () или отличается от всех остальных только один (), то возможность различного расположения лигандов по отношению друг к другу отсутствует. Например, у октаэдрических соединений любое положение лиганда L ′′ по отношению к остальным пяти лигандам L ′ будет равноценным и поэтому изомеров здесь не должно быть:
Появление двух лигандов L ′′ в октаэдрических комплексных соединениях приведет к возможности существования двух геометрических изомеров . В этом случае появляются два различных способа расположения лигандов L ′′ друг относительно друга. Например, катион дигидроксотетраамминкобальта(III) + имеет два изомера:
При попытке найти какое-нибудь еще взаимное расположение лигандов H 3 N и OH - , которое отличалось бы от указанных выше, мы всегда придем к строению одного из уже приведенных.
При увеличении в комплексе числа лигандов, имеющих разный химический состав, число геометрических изомеров быстро растет. У соединений типа будет четыре изомера, а у соединений типа , содержащих шесть разных лигандов, число геометрических изомеров достигает 15. Подобные комплексные соединения пока еще мало изучены.
Геометрические изомеры существенно отличаются по физико-химическим свойствам, таким как цвет, растворимость, плотность, кристаллическая структура и т.д.
В ходе урока вы получите общее представление о видах изомерии, узнаете, что такое изомер. Узнаете о видах изомерии в органической химии: структурной и пространственной (стереоизомерии). С помощью структурных формул веществ рассмотрите подвиды структурной изомерии (скелетную и изомерию положений), узнаете о разновидностях пространственной изомерии: геометрической и оптической.
Тема: Введение в органическую химию
Урок: Изомерия. Виды изомерии. Структурная изомерия, геометрическая, оптическая
Рассмотренные нами ранее виды формул, описывающих органические вещества, показывают, что одной молекулярной может соответствовать несколько разных структурных формул.
Например, молекулярной формуле C 2 H 6 O соответствуют два вещества с разными структурными формулами - этиловый спирт и диметиловый эфир. Рис. 1.
Этиловый спирт - жидкость, которая реагирует с металлическим натрием с выделением водорода, кипит при +78,5 0 С. При тех же условиях диметиловый эфир - газ, не реагирующий с натрием, кипит при -23 0 С.
Эти вещества отличаются своим строением - разным веществам соответствует одинаковая молекулярная формула.
Рис. 1. Межклассовая изомерия
Явление существования веществ, имеющих одинаковый состав, но разное строение и поэтому разные свойства называют изомерией (от греческих слов «изос» - «равный» и «мерос» - «часть», «доля»).
Типы изомерии
Существуют разные типы изомерии.
Структурная изомерия связана с разным порядком соединения атомов в молекуле.
Этанол и диметиловый эфир - структурные изомеры. Поскольку они относятся к разным классам органических соединений, такой вид структурной изомерии называется еще и межклассовой . Рис. 1.
Структурные изомеры могут быть и внутри одного класса соединений, например формуле C 5 H 12 соответствуют три разных углеводорода. Это изомерия углеродного скелета . Рис. 2.

Рис. 2 Примеры веществ - структурных изомеров
Существуют структурные изомеры с одинаковым углеродным скелетом, которые отличаются положением кратных связей (двойных и тройных) или атомов, замещающих водород. Этот вид структурной изомерии называется изомерией положения .
Рис. 3. Структурная изомерия положения
В молекулах, содержащих только одинарные связи, при комнатной температуре возможно почти свободное вращение фрагментов молекулы вокруг связей, и, например, все изображения формул 1,2-дихлорэтана равноценны. Рис. 4

Рис. 4. Положение атомов хлора вокруг одинарной связи
Если же вращение затруднено, например, в циклической молекуле или при двойной связи, то возникает геометрическая или цис-транс изомерия. В цис-изомерах заместители находятся по одну сторону плоскости цикла или двойной связи, в транс-изомерах - по разные стороны.
Цис-транс изомеры существуют в том случае, когда с атомом углерода связаны два разных заместителя. Рис. 5.



Рис. 5. Цис- и транс- изомеры
Еще один тип изомерии возникает в связи с тем, что атом углерода с четырьмя одинарными связями образует со своими заместителями пространственную структуру - тетраэдр. Если в молекуле есть хотя бы один углеродный атом, связанный с четырьмя разными заместителями, возникает оптическая изомерия . Такие молекулы не совпадают со своим зеркальным изображением. Это свойство называется хиральностью - от греческого с hier - «рука». Рис. 6. Оптическая изомерия характерна для многих молекул, входящих в состав живых организмов.
|
|
|
Рис. 6. Примеры оптических изомеров
Оптическая изомерия называется также энантиомерией (от греческого enantios - «противоположный» и meros - «часть»), а оптические изомеры - энантиомерами . Энантиомеры оптически активны, они вращают плоскость поляризации света на один и тот же угол, но в противоположные стороны: d- , или (+)-изомер, - вправо, l- , или (-)-изомер, - влево. Смесь равных количеств энантиомеров, называемая рацематом , оптически недеятельна и обозначается символом d,l- или (±).
Подведение итога урока
В ходе урока вы получили общее представление о видах изомерии, что такое изомер. Узнали о видах изомерии в органической химии: структурной и пространственной (стереоизомерии). С помощью структурных формул веществ рассмотрели подвиды структурной изомерии (скелетную и изомерию положений), познакомились с разновидностями пространственной изомерии: геометрической и оптической.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф.Г. Фельдман. - 14-е издание. - М.: Просвещение, 2012.
2. Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. - М.: Дрофа, 2008. - 463 с.
3. Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. - М.: Дрофа, 2010. - 462 с.
4. Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. - 4-е изд. - М.: РИА «Новая волна»: Издатель Умеренков, 2012. - 278 с.
Домашнее задание
1. №№ 1,2 (с.39) Рудзитис Г.Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. - 14-е издание. - М.: Просвещение, 2012.
2. Почему число изомеров у углеводородов ряда этилена больше, чем предельных углеводородов?
3. Какие углеводороды имеют пространственные изомеры?
1. Структурная изомерия.
2. Конформационная изомерия.
3. Геометрическая изомерия.
4. Оптическая изомерия.
Изомеры – это вещества, имеющие одинаковый состав и молекулярную массу, но разные физические и химические свойства. Различия в свойствах изомеров обусловлены различиями в их химическом или пространственном строении. В связи с этим различают два вида изомерии.
изомерия
структурная
пространственная
Углеродного скелета
Конфигурационная
Конформационная
Положение функциональной
Оптическая
Межклассовая
Геометрическая
1. Структурная изомерия
Структурные изомеры отличаются химическим строением, т.е. природой и последовательностью связей между атомами в молекуле. Структурные изомеры выделяют в чистом виде. Они существуют как индивидуальные, устойчивые вещества, для их взаимного превращения необходима высокая энергия - порядка 350 - 400 кДж/моль. В динамическом равновесии находятся только структурные изомеры - таутомеры. Таутомерия - распространенное явление в органической химии. Она возможна при переносе подвижного атома водорода в молекуле (карбонильные соединения, амины, гетероциклы и т.д.), внутримолекулярных взаимодействиях (углеводы).
Все структурные изомеры представляют в виде структурных формул и называют по номенклатуре ИЮПАК. Например, составу С 4 Н 8 О соответствуют структурные изомеры:
а) с различным углеродным скелетом
неразветвленная С-цепь - СН 3 -СН 2 -СН 2 -СН=О (бутаналь, альдегид) и
разветвленная С-цепь -
 (2-метилпропаналь,
альдегид) или
(2-метилпропаналь,
альдегид) или
цикл -  (циклобутанол, циклический спирт);
(циклобутанол, циклический спирт);
б) с различным положением функциональной группы
 бутанон-2, кетон;
бутанон-2, кетон;
в) с различным составом функциональной группы
 3-бутенол-2,
непредельный спирт;
3-бутенол-2,
непредельный спирт;
г) метамерии
Гетероатом функциональной группы может быть включен в углеродный скелет (цикл или цепь). Один из возможных изомеров этого вида изомерии - СН 3 -О-СН 2 -СН=СН 2 (3-метоксипропен-1, простой эфир);
д) таутомерии (кето-енольной)
енольная форма
 кетоформа
кетоформа
Таутомеры находятся в динамическом равновесии, при этом в смеси преобладает более устойчивая форма – кетоформа.
Для ароматических соединений структурную изомерию рассматривают только для боковой цепи.
2. Пространственная изомерия (стереоизомерия)
Пространственные изомеры имеют одинаковое химическое строение, различаются по пространственному расположению атомов в молекуле. Это различие и создает разницу в физических и химических свойствах. Пространственные изомеры изображают в виде различных проекций или стереохимических формул. Раздел химии, изучающий пространственное строение и его влияние на физические и химические свойства соединений, на направление и скорость их реакций, называется стереохимией.
а) Конформационная (поворотная) изомерия
Не меняя ни валентных углов, ни длин связей, можно представить себе множество геометрических форм (конформаций) молекулы, отличающихся друг от друга взаимным поворотом углеродных тетраэдров вокруг соединяющей их σ-С-С-связи. В результате такого вращения возникают поворотные изомеры (конформеры). Энергия различных конформеров неодинакова, но энергетический барьер, разделяющий различные конформационные изомеры, для большинства органических соединений невелик. Поэтому при обычных условиях, как правило, нельзя зафиксировать молекулы в одной строго определенной конформации. Обычно в равновесии сосуществуют несколько легко переходящих друг в друга конформационных изомеров.
Способы изображения и номенклатуру изомеров можно рассмотреть на примере молекулы этана. Для нее можно предвидеть существование двух, максимально различающихся по энергии конформаций, которые могут быть изображены в виде перспективных проекций (1) («лесопильные козлы») или проекций Ньюмена (2):

заторможенная конформация заслоненная конформация
В перспективной проекции (1) связь С-С надо представить себе уходящей вдаль; стоящий слева углеродный атом приближен к наблюдателю, стоящий справа - удален от него.
В проекции Ньюмена (2) молекулу рассматривают вдоль связи С-С. Три линии, расходящиеся под углом 120 о из центра круга, обозначают связи ближайшего к наблюдателю углеродного атома; линии, «высовывающиеся» из-за круга - связи удаленного углеродного атома.
Изображенную справа конформацию называют заслоненной . Это название напоминает о том, что атомы водорода обеих СН 3 -групп находятся друг против друга. Заслоненная конформация имеет повышенную внутреннюю энергию и поэтому невыгодна. Конформацию, изображенную слева, называют заторможенной , подразумевая, что свободное вращение вокруг связи С-С «тормозится» в этом положении, т.е. молекула существует преимущественно в этой конформации.
Минимум энергии, необходимый для полного вращения молекулы вокруг определенной связи, называется барьером вращения для данной связи. Барьер вращения в молекуле, подобной этану, может быть выражен через изменение потенциальной энергии молекулы как функции изменения двугранного (торсионного - τ) угла системы. Энергетический профиль вращения вокруг связи С-С в этане показан на рисунке 1. Барьер вращения, разделяющий две формы этана, составляет около 3 ккал/моль (12,6 кДж/моль). Минимумы кривой потенциальной энергии соответствуют заторможенным конформациям, максимумы - заслоненным. Поскольку при комнатной температуре энергия некоторых столкновений молекул может достигать 20 ккал/моль (около 80 кДж/моль), то этот барьер в 12,6 кДж/моль легко преодолевается и вращение в этане рассматривают как свободное. В смеси всех возможных конформаций преобладают заторможенные конформации.

Рис.1. Диаграмма потенциальной энергии конформаций этана.
Для более сложных молекул число возможных конформаций возрастает. Так, для н -бутана можно изобразить уже шесть конформаций, возникающих при повороте вокруг центральной связи С 2 - С 3 и отличающихся взаимным расположением СН 3 -групп. Различные заслоненные и заторможенные конформации бутана отличаются по энергии. Энергетически более выгодны заторможенные конформации.

Энергетический профиль вращения вокруг связи С 2 -С 3 в бутане показан на рисунке 2.

Рис.2. Диаграмма потенциальной энергии конформаций н-бутана.
Для молекулы с длинной углеродной цепью число конформационных форм возрастает.
Для молекулы алициклических соединений характерны различные конформационные формы цикла (например, для циклогексана кресло , ванна , твист -формы).
Итак, конформации - это различные пространственные формы молекулы, имеющей определенную конфигурацию. Конформерами являются стереоизомерные структуры, соответствующие энергетическим минимумам на диаграмме потенциальной энергии, находящиеся в подвижном равновесии и способные к взаимопревращению путем вращения вокруг простых σ-связей.
Если барьер таких превращений становится достаточно высоким, то можно разделить стереоизомерные формы (пример - оптически активные дифенилы). В таких случаях говорят уже не о конформерах, а о реально существующих стереоизомерах.
б) Геометрическая изомерия
Геометрические изомеры возникают в результате отсутствия в молекуле:
1. вращения атомов углерода относительно друг друга - следствие жесткости двойной связи С=С или циклической структуры;
2. двух одинаковых групп при одном атоме углерода двойной связи или цикла.
Геометрические изомеры, в отличие от конформеров, могут быть выделены в чистом виде и существуют как индивидуальные, устойчивые вещества. Для их взаимного превращения необходима более высокая энергия - порядка 125-170 кДж/моль (30-40 ккал/моль).
Различают цис-транс-(Z,E) изомеры; цис- формами называют геометрические изомеры, у которых одинаковые заместители лежат по одну сторону от плоскости π-связи или цикла, транс- формами называют геометрические изомеры, у которых одинаковые заместители лежат по разные стороны от плоскости π-связи или цикла.
Простейшим примером могут служить изомеры бутена-2, который существует в виде цис- , транс-геометрических изомеров:


цис-бутен-2 транс-бутен-2
температура плавления
138,9 0 С - 105,6 0 С
температура кипения
3,72 0 С 1,00 0 С
плотность
1,2 – дихлорциклопропан существует в виде цис- , транс-изомеров:


цис-1,2-дихлорциклопропан транс-1,2-дихлорциклопропан
В более сложных случаях применяется Z ,E-номенклатура (номенклатура Канна, Ингольда, Прелога – КИП, номенклатура старшинства заместителей). В соединении
1-бром -2-метил-1-хлорбутене-1 (Br)(CI)С=С(СН 3) - СН 2 -СН 3 все заместители при атомах углерода с двойной связью различные; поэтому данное соединение существует в виде Z-, E- геометрических изомеров:


Е-1-бром-2-метил-1-хлорбутен-1 Z-1-бром-2-метил-1-хлорбутен-1.
Для обозначения конфигурации изомера указывают расположение старших заместителей при двойной связи (или цикле) – Z-(от немецкого Zusammen - вместе) или Е-(от немецкого Entgegen - напротив).
В Z,E-системе старшими считаются заместители с большим порядковым (атомным) номером. Если атомы, непосредственно связанные с ненасыщенными атомами углерода, одинаковы, то переходят ко "второму слою", в случае необходимости - к "третьему слою" и т. д.
В первой проекции старшие группы находятся напротив друг друга относительно двойной связи, поэтому это Е-изомер. Во второй проекции старшие группы расположены по одну сторону относительно двойной связи (вместе), поэтому это Z-изомер.
Геометрические изомеры широко распространены в природе. Например, природные полимеры каучук (цис-изомер) и гуттаперча (транс-изомер), природная фумаровая (транс-бутендиовая кислота) и синтетическая малеиновая (цис-бутендиовая кислота) кислоты, в составе жиров - цис-олеиновая, линолевая, линоленовая кислоты.
в) Оптическая изомерия
Молекулы органических соединений могут быть хиральными и ахиральными. Хиральность(от греч. сheir - рука) - несовместимость молекулы со своим зеркальным отражением.
Хиральные вещества способны вращать плоскость поляризации света. Это явление называют оптической активностью, а соответствующие вещества - оптически активными . Оптически активные вещества встречаются в виде пар оптических антиподов - изомеров, физические и химические свойства которых в обычных условиях одинаковы, за исключением одного - знака вращения плоскости поляризации: один из оптических антиподов отклоняет плоскость поляризации в право (+, правовращающий изомер), другой – влево (-, левовращающий). Определить конфигурацию оптических антиподов можно экспериментально с помощью прибора - поляриметра.
Оптическая изомерия появляется тогда, когда в молекуле присутствует асимметрический атом углерода (существуют и другие причины хиральности молекулы) . Так называют атом углерода в sр 3 - гибридизации и связанный с четырьмя различными заместителями. Возможны два тетраэдрических расположения заместителей вокруг асимметрического атома. При этом две пространственные формы нельзя совместить никаким вращением; одна из них является зеркальным изображением другой:

Обе зеркальные формы составляют пару оптических антиподов или энантиомеров .
Изображают оптические изомеры в виде проекционных формул Э. Фишера. Их получают в результате проецирования молекулы с асимметрическим атомом углерода. При этом сам асимметрический атом углерода на плоскости обозначают точкой, на горизонтальной линии указывают символы заместителей, выступающих перед плоскостью рисунка. На вертикальной линии (прерывистой или сплошной) указывают заместители, которые удалены за плоскость рисунка. Ниже приведены различные способы записи проекционной формулы, отвечающей левой модели на предыдущем рисунке:

В проекции главную углеродную цепь изображают вертикально; главную функцию, если она находится в конце цепи, указывают в верхней части проекции. Например, стереохимические и проекционные формулы (+) и (-) аланина - СН 3 - * СН(NН 2)-СООН представляют следующим образом:

Смесь с одинаковым содержанием энантиомеров называется рацематом. Рацемат не обладает оптической активностью и характеризуется отличными от энантиомеров физическими свойствами.
Правила преобразования проекционных формул.
1. Формулы можно вращать в плоскости чертежа на 180 о, не меняя их стереохимического смысла:

2. Две (или любое четное число) перестановки заместителей у одного асимметрического атома не меняют стереохимического смысла формулы:

3. Одна (или любое нечетное число) перестановка заместителей у асимметрического центра приводит к формуле оптического антипода:

4. Поворот в плоскости чертежа на 90 о превращает формулу в антипод.
5. Вращение любых трех заместителей по часовой стрелке или против не меняет стереохимического смысла формулы:
 6.
Проекционные формулы нельзя выводить
из плоскости чертежа.
6.
Проекционные формулы нельзя выводить
из плоскости чертежа.
Оптической активностью обладают органические соединения, в молекулах которых хиральными центрами являются и другие атомы, например кремния, фосфора, азота, серы.
Соединения с несколькими асимметрическими атомами углерода существуют в виде диастереомеров , т.е. пространственных изомеров, не составляющих друг с другом оптических антиподов.
Диастереомеры отличаются друг от друга не только оптическим вращением, но и всеми другими физическими константами: у них разные температуры плавления и кипения, разные растворимости и др.
Число пространственных изомеров определяют по формуле Фишера N=2 n , где n - число асимметрических атомов углерода. Число стереоизомеров может уменьшаться из-за частичной симметрии, появляющейся в некоторых структурах. Оптически неактивные диастереомеры называют мезо -формами.
Номенклатура оптических изомеров:
а) D- , L- номенклатура
Для определения D- или L-ряда изомера конфигурацию (положение ОН–группы у асимметричного атома углерода) сравнивают с конфигурациями энантиомеров глицеринового альдегида (глицериновый ключ):

L-глицериновый альдегид D-глицериновый альдегид
Применение D-, L-номенклатуры в настоящее время ограничено тремя классами оптически активных веществ: углеводами, аминокислотами и оксикислотами.
б) R -, S-номенклатура (номенклатура Кана, Ингольда и Прелога)
Для определения R(правый)- или S(левый)-конфигурации оптического изомера необходимо расположить заместители в тетраэдре (стереохимической формуле) вокруг асимметрического углеродного атома таким образом, чтобы самый младший заместитель (обычно это водород) имел направление «от наблюдателя». Если переход трех остальных заместителей от старшего к среднему и младшему по старшинству происходит по часовой стрелке- это R-изомер (падение старшинства совпадает с движением руки при написании верхней части буквы R). Если переход происходит против часовой стрелки - это S- изомер (падение старшинства совпадает с движением руки при написании верхней части буквы S).
Для определения R- или S-конфигурации оптического изомера по проекционной формуле необходимо путем четного числа перестановок расположить заместители так, чтобы самый младший из них оказался внизу проекции. Падение старшинства остальных трех заместителей по часовой стрелке соответствует R-конфигурации, против часовой стрелки - S-конфигурации.
Получают оптические изомеры следующими методами:
а) выделение из природных материалов, содержащих оптически активные соединения, например белки и аминокислоты, углеводы, многие оксикислоты (винная, яблочная, миндальная), терпеновые углеводороды, терпеновые спирты и кетоны, стероиды, алкалоиды и др.
б) расщепление рацематов;
в) асимметрический синтез;
г) биохимическое получение оптически активных веществ.
ЗНАЕТЕ ЛИ ВЫ, ЧТО
Явление изомерии (от греч.- i sos - разный и meros - доля, часть) открыто в 1823г. Ю. Либихом и Ф. Вёлером на примере солей двух неорганических кислот: циановой Н-О-С≡N и гремучей Н-О-N= С.
В 1830 г. Ж.Дюма распространил представление об изомерии на органические соединения.
В 1831г. термин «изомер» для органических соединений предложил Й. Берцелиус.
Стереоизомеры природных соединений характеризуются разной биологической активностью (аминокислоты, углеводы, алкалоиды, гормоны, феромоны, лекарственные вещества природного происхождения и т.д.).